Dia Nacional do Medicamento Genérico
Foi comemorado na segunda-feira (20/5) o Dia Nacional do Medicamento Genérico, um dos mais importantes produtos do mercado farmacêutico e exemplo de política de saúde exitosa no país. A importância dos genéricos está associada à oferta de medicamentos seguros, eficazes e de qualidade, além de representar garantia de acesso a produtos com menor preço. Isso porque esses medicamentos são, no mínimo, 35% mais baratos que os de referência.
Outro fato importante é que a concorrência entre genéricos e medicamentos de referência tende a baixar o preço de ambos, beneficiando o consumidor de todas as formas. De acordo com a Anvisa, o genérico inédito, após o término da patente do produto de referência, representa uma redução significativa do custo do tratamento. É importante ressaltar também que os genéricos geram economia para o Sistema Único de Saúde (SUS), por oferecerem alternativas mais baratas e igualmente eficazes no tratamento de doenças.
Do ponto de vista econômico, os genéricos e similares (que atendem às mesmas exigências regulatórias que os genéricos) têm peso significativo no mercado, sendo os campeões de vendas de medicamentos no Brasil em 2017, com a marca de 2,9 bilhões de embalagens comercializadas – 65% do total de caixas vendidas. Também representaram um terço do faturamento global do setor farmacêutico em 2017, chegando a R$ 23,5 bilhões em produtos comercializados – 33,9% do total.
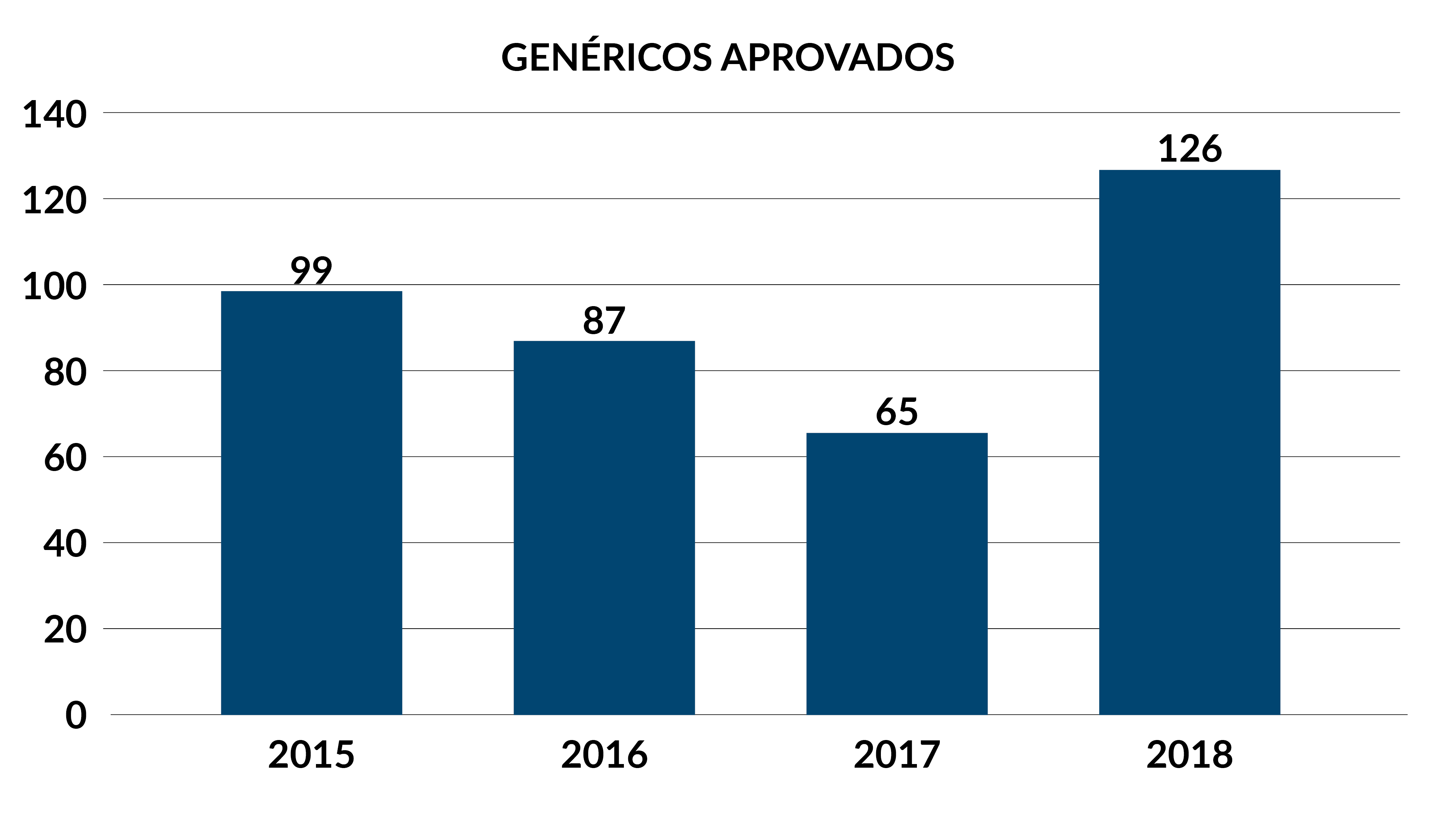
Em 2018, houve um incremento de medicamento genéricos no mercado. De acordo com a Anvisa, somente no ano passado foram publicados 126 registros desses produtos, o que representou um aumento de 94% em relação ao ano de 2017. Dentre esses novos registros, 25 foram de genéricos inéditos, dos quais 20 foram classificados como novos fármacos.
Redução do tempo de análise de petições
Para a Agência, o crescimento do número de registros está diretamente associado ao aperfeiçoamento da análise e melhorias no processo de trabalho. Atualmente, a espera para início da avalição de petições é menor que um ano, resultado considerado positivo na avaliação da Anvisa.
Esse processo foi desencadeado a partir da implementação do Projeto Estratégico n. 1, alavancado pela Lei 13.411, de dezembro de 2016, que prevê o aprimoramento da análise das solicitações de empresas relativas a novos registros e pós-registros.
De acordo com a Anvisa, após a implementação da Lei 13.411/2016, que passou a vigorar a partir de março de 2017, houve a entrada de 194 pedidos de registro de genéricos. Destes, 73 foram concluídos com tempo médio de 304,8 dias entre a entrada da petição e a publicação da avaliação da Anvisa.
Outros 52 processos estão em análise ou já em período de exigência, quando a Anvisa solicita a complementação das informações enviadas pela empresa ou a resolução de alguma pendência. Outras 65 solicitações aguardam pela análise. Também houve quatro desistências por parte das empresas solicitantes.
Fonte: Agência Nacional de Vigilância Sanitária (Anvisa)
Leia também: Publicidade e propaganda de medicamentos